Imagina por un momento que el mar burbujea como un refresco. Aunque suene extraño, esta comparación nos ayuda a entender un fenómeno real: la absorción de dióxido de carbono por las aguas marinas. Los mares ya contienen grandes cantidades de este gas disuelto, interactuando constantemente con el agua en un equilibrio químico vital.
El CO₂ atmosférico, aunque representa solo el 0.042% del aire, juega un papel crucial. Al entrar en contacto con el agua, genera reacciones que modifican su acidez. Este proceso natural se ha intensificado en las últimas décadas, transformando lentamente la composición química de los mares.
¿Por qué usar esta analogía? Comparar el océano con una bebida gaseosa simplifica conceptos complejos. Permite visualizar cómo el aumento de CO₂ afecta a los ecosistemas marinos, incluso cuando los cambios no son visibles a simple vista.
En este viaje descubriremos cómo este “refresco natural” regula el clima global y qué consecuencias tiene su alteración. Prepárate para explorar un mundo donde la química marina se convierte en protagonista de nuestra historia ambiental.
Conclusiones clave
- La comparación con bebidas gaseosas ayuda a comprender procesos químicos complejos
- El CO₂ atmosférico modifica constantemente la composición del agua marina
- Los océanos actúan como reguladores naturales del clima global
- Pequeños cambios químicos tienen grandes impactos ecológicos
- La acidificación oceánica es un proceso actual y medible
Introducción al misterio del océano y el CO2
Nuestro planeta funciona como un reloj cósmico donde cada componente, por pequeño que parezca, mantiene el equilibrio. El dióxido de carbono, aunque solo representa 42 moléculas por cada 100,000 en la atmósfera, actúa como termostato global. Sin este gas, la Tierra sería un bloque de hielo.
El papel del dióxido de carbono en el planeta
Este gas invisible realiza dos funciones vitales: atrapa calor solar y alimenta la fotosíntesis. Las actividades humanas han aumentado su concentración un 50% desde 1850. Cada año, emitimos 40,000 millones de toneladas de CO₂, equivalentes a 630,000 estadios deportivos llenos de este gas.
Los océanos absorben el 30% de estas emisiones. Imagina 12,000 millones de camiones cisterna descargando carbono en el mar cada día. Este proceso silencioso evita que el calentamiento global sea el doble de intenso.
La relevancia del océano en el ciclo del carbono
Las aguas marinas almacenan 50 veces más carbono que la atmósfera. Su mecanismo funciona en capas: fitoplancton absorbe CO₂ en superficie, mientras corrientes profundas lo transportan por siglos.
“Los mares son el pulmón líquido del planeta”
Este sistema natural enfrenta estrés extremo. Desde 1980, la acidificación oceánica aumentó 26%. ¿Cómo afecta esto a ecosistemas marinos? La investigación revela cambios en especies clave que sostienen la vida acuática.
Los datos muestran una verdad incómoda: mientras quemamos combustibles fósiles, dependemos de los océanos para mitigar el cambio climático. Un equilibrio frágil que define nuestro futuro ambiental.
La química del océano: de dióxido de carbono a ácido carbónico
¿Alguna vez te has preguntado cómo interactúan los gases con el agua marina? Cuando el CO₂ atmosférico se encuentra con el mar, inicia una transformación química fascinante. Este proceso silencioso altera la composición del agua y afecta a todo el ecosistema marino.
Formación y reacción del ácido carbónico
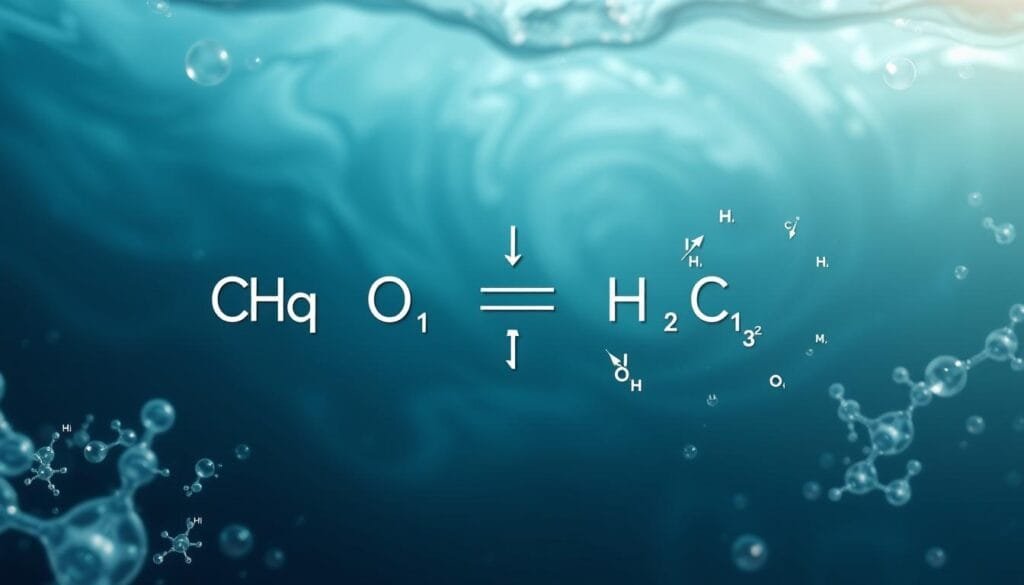
El primer paso ocurre en la superficie marina. El dióxido de carbono se disuelve siguiendo un principio básico: las moléculas fluyen de zonas de mayor a menor concentración. Al entrar al agua, el CO₂ reacciona formando ácido carbónico (H₂CO₃). La ecuación química es simple pero poderosa:
- CO₂ + H₂O → H₂CO₃
Este compuesto es inestable y rápidamente se divide en iones. Según estudios del Instituto Biointeractivo, el 70% del carbono marino se transforma en bicarbonato.
Procesos químicos y diferencias de concentración
El mar funciona como un laboratorio natural. Tres compuestos dominan esta química:
- Ácido carbónico (regula el pH)
- Bicarbonato (almacena carbono)
- Carbonato (esencial para conchas y corales)
Las zonas profundas almacenan 60% más carbono que la superficie. Este equilibrio, descrito en investigaciones recientes, mantuvo estable el pH marino durante milenios. Hoy, las emisiones humanas aceleran el proceso 100 veces más rápido que cambios naturales.
Impactos ambientales y la acidificación de los océanos
¿Sabías que los mares están perdiendo su capacidad de proteger la vida submarina? Desde 1850, el pH marino ha bajado 0.1 unidades. Esto equivale a un 30% más de acidez, según datos científicos recientes. El cambio, aunque parece pequeño, altera todo el equilibrio químico que sostiene ecosistemas enteros.
Efectos en la vida marina y arrecifes coralinos
Los arrecifes de coral albergan el 25% de las especies marinas. Pero en aguas más ácidas, sus esqueletos de carbonato se debilitan. Imagina un edificio que pierde sus vigas de acero: así colapsan estos “bosques submarinos” cuando el agua no tiene suficientes minerales.
Ostras, almejas y plancton enfrentan el mismo problema. Sus caparazones se vuelven frágiles como papel mojado. Un estudio reveló que algunas larvas de erizos de mar reducen su crecimiento un 40% en estas condiciones.
Cambios en el pH y su repercusión en organismos
Cada punto en la escala pH representa un cambio diez veces mayor en acidez. Para 2100, las aguas superficiales podrían ser 150% más ácidas. Esto significa menos iones de carbonato disponibles, según explica National Geographic.
Los corales de aguas poco profundas son los más afectados. Si el ritmo actual continúa, para 2050 muchos arrecifes desaparecerán más rápido de lo que se regeneran. ¿Qué pasaría si estos ecosistemas colapsan? Este escenario hipotético nos muestra la urgencia de actuar.

