Imagina un mundo donde enfermedades como el cáncer o el alzhéimer sean cosa del pasado. Esto es lo que promete la edición genética, una tecnología revolucionaria que permite modificar el ADN con precisión nunca antes vista. Desde su descubrimiento, ha generado esperanzas para tratar condiciones hereditarias y mejorar la salud global.
Pero no todo es optimismo. Alterar el código de la vida plantea preguntas profundas: ¿hasta dónde debemos intervenir en la naturaleza? ¿Quién decide los límites? Aunque las primeras aplicaciones se centran en terapias médicas, el uso en células germinales o para fines no médicos abre debates complejos.
Esta técnica no surgió de la noche a la mañana. Evolucionó desde métodos menos precisos hasta convertirse en una herramienta accesible para laboratorios de todo el mundo. Su rapidez y bajo costo han acelerado la investigación, pero también exigen regulaciones claras para evitar riesgos imprevistos.
En este artículo, exploraremos cómo la ciencia está reescribiendo las posibilidades de la medicina. Analizaremos casos reales, avances recientes y los desafíos que enfrentamos como sociedad. ¿Listo para adentrarte en este fascinante tema?
Conclusiones clave
- La edición genética podría eliminar enfermedades hereditarias y mejorar tratamientos médicos
- Existen riesgos biológicos y sociales al modificar el ADN humano
- La tecnología avanza más rápido que las leyes que la regulan
- El debate ético involucra a científicos, gobiernos y la sociedad en general
- Algunos países ya realizan ensayos clínicos con resultados prometedores
- La transparencia en la investigación es clave para ganar confianza pública
Introducción y contexto histórico
La capacidad de reescribir el ADN humano ha pasado de la ciencia ficción a los laboratorios en pocas décadas. Este viaje científico comenzó con métodos rudimentarios en los años 70, donde la modificación genética era lenta y poco precisa. Herramientas como las nucleasas de dedos de zinc (ZFNs) marcaron un primer avance, permitiendo cortes específicos en el genoma durante los 90.
Origen y evolución de las tecnologías de edición genética
En los 2000, aparecieron los TALENs, más flexibles pero complejos de diseñar. Estos sistemas funcionaban como tijeras moleculares, aunque su proceso de implementación requería meses de trabajo especializado. Grupos de investigación en Europa y Asia perfeccionaron estas técnicas, sentando las bases para lo que vendría después.
La llegada de CRISPR al ámbito científico
El año 2012 cambió todo. Un equipo internacional descubrió cómo usar el sistema CRISPR-Cas9 de bacterias para edición genómica en mamíferos. Esta tecnología destacó por su rapidez, costo accesible y alta precisión comparada con métodos anteriores.
Desde entonces, más de 6,000 estudios han explorado sus aplicaciones. Laboratorios de Harvard al MIT aceleraron su desarrollo, mientras surgían debates sobre su uso en células germinales. La comunidad científica reconoce este hito como uno de los mayores avances en biotecnología del siglo XXI.
Los fundamentos de la edición genética
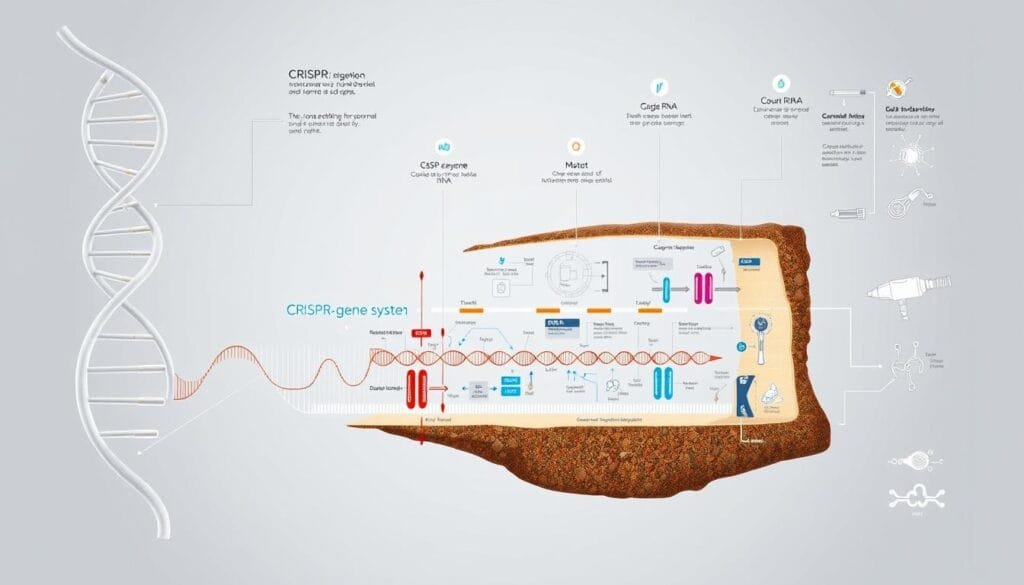
El corazón de la edición genética late en moléculas que funcionan como navajas suizas microscópicas. Estas herramientas biológicas identifican secuencias específicas de ADN y realizan cambios precisos, como si fueran cirujanos moleculares. Su desarrollo ha transformado la investigación médica, ofreciendo esperanzas reales para tratar condiciones complejas.
Mecanismos y herramientas básicas
Los sistemas modernos de edición genómica usan guías de ARN para localizar genes exactos. A diferencia de métodos anteriores como los TALENs, que requerían diseño manual, las nuevas técnicas automatizan este proceso. “La precisión actual supera el 99% en condiciones controladas”, señala un estudio publicado en Nature Biotechnology.
Estas son las claves del proceso:
- Enzimas especializadas cortan el ADN en puntos predeterminados
- Sistemas de reparación celular insertan o modifican genes
- Tecnologías de seguimiento detectan efectos no deseados
Las células germinales plantean desafíos únicos: cualquier cambio se hereda a futuras generaciones. Por eso, los laboratorios priorizan protocolos de seguridad. Equipos en Stanford y el Broad Institute han reducido errores de edición usando inteligencia artificial predictiva.
La innovación no se detiene. Nuevas variantes como el sistema prime editing permiten reescribir genomas sin romper la doble hélice del ADN. Estas mejoras buscan minimizar riesgos mientras amplían aplicaciones terapéuticas.
La tecnología CRISPR: Innovación y aplicaciones
Los avances en modificación genética están transformando nuestra realidad desde hospitales hasta campos de cultivo. Esta revolución científica abre caminos impensados para resolver desafíos globales, combinando precisión molecular con aplicaciones prácticas.
Aplicaciones en la medicina
En el ámbito médico, la edición genómica ya muestra resultados concretos. Pacientes con anemia falciforme, una enfermedad hereditaria que afecta la hemoglobina, han experimentado mejoras significativas tras terapias experimentales. “Estamos reescribiendo el futuro de las enfermedades genéticas”, comenta un investigador del Instituto Broad.
Los tratamientos innovadores funcionan modificando genes defectuosos en células madre sanguíneas. Este enfoque podría aplicarse a más de 6,000 condiciones hereditarias. Actualmente, 32 ensayos clínicos activos exploran su uso contra cánceres y trastornos metabólicos.
Uso en la agricultura y medio ambiente
Fuera de los laboratorios médicos, esta tecnología ayuda a crear cultivos resistentes a sequías y plagas. Científicos en California desarrollaron arroz modificado que requiere 40% menos agua. Otros proyectos buscan restaurar ecosistemas mediante modificaciones en el ADN de especies en peligro.
La sostenibilidad ambiental se beneficia con soluciones como:
- Bacterias editadas para degradar plásticos
- Plantas que absorben más CO₂
- Microorganismos que limpian suelos contaminados
Estos avances demuestran cómo las tecnologías de edición genética pueden abordar simultáneamente problemas de salud y crisis ecológicas. Su impacto global dependerá de un uso responsable y acceso equitativo.
Dilemas éticos CRISPR

¿Qué ocurre cuando la ciencia supera nuestra capacidad para establecer límites? La posibilidad de alterar el código de la vida humana genera discusiones que van más allá de los laboratorios. Expertos en bioética advierten sobre consecuencias impredecibles, mientras algunos investigadores destacan su potencial para erradicar males ancestrales.
Voces a favor y en contra del progreso
Organizaciones como la UNESCO piden regulación global para evitar usos no médicos. “Modificar embriones podría crear desigualdades biológicas irreversibles”, alerta un informe de 2023. En contraste, premios Nobel como Jennifer Doudna defienden su aplicación controlada: “Negar estas terapias sería éticamente cuestionable”.
El caso del científico chino He Jiankui muestra los riesgos. En 2018, modificó genes en embriones humanos sin aprobación ética, generando condena mundial. Este hecho evidenció fallas en los sistemas de supervisión y la necesidad de protocolos más estrictos.
El dilema de las generaciones futuras
La edición en línea germinal plantea un desafío único: cambios que afectarían a descendientes no nacidos. Mientras algunos argumentan que podría eliminar enfermedades hereditarias, otros temen efectos en cascada en el patrimonio genético humano.
¿Dónde trazar la línea entre cura y mejora? La sociedad enfrenta una encrucijada histórica. Avances recientes exigen diálogos transparentes que incluyan a ciudadanos comunes, no solo a especialistas. El equilibrio entre innovación y precaución definirá el rumbo de esta revolución científica.
Riesgos y beneficios de la edición genómica
Equilibrar avances médicos con precaución científica marca el debate actual en genómica. Mientras algunos laboratorios reportan éxitos contra enfermedades hereditarias, otros advierten sobre consecuencias imprevistas que podrían afectar a individuos y ecosistemas. Un estudio de 2023 en Science Advances revela que el 18% de las terapias experimentales presentan efectos secundarios no previstos.
Análisis de los posibles efectos no deseados
La edición genética muestra dos caras. Por un lado, corrige mutaciones causantes de enfermedades como la fibrosis quística. Por otro, puede alterar regiones del ADN no objetivo, según datos del Instituto Nacional de Salud de EE.UU. Estos errores, aunque mínimos, plantean desafíos para su uso masivo.
La siguiente tabla compara beneficios y riesgos clave:
| Aspecto | Beneficios | Riesgos |
|---|---|---|
| Precisión | Corrección exacta de genes defectuosos | Ediciones fuera de objetivo (0.5-5% casos) |
| Efectos no deseados | – | Activación de oncogenes en 2% de terapias |
| Accesibilidad | Costos reducidos en 70% desde 2018 | Disparidades en acceso a tratamientos |
| Impacto a largo plazo | Erradicación de enfermedades familiares | Cambios heredables no controlados |
Investigaciones recientes demuestran avances. La Universidad de Harvard logró reducir ediciones erróneas en un 89% usando inteligencia artificial. “Cada éxito acerca nuevas preguntas sobre seguridad”, afirma un bioingeniero participante en el estudio. Mantener este equilibrio será crucial para el futuro de la investigación genómica.
Seguridad en la aplicación de CRISPR

Garantizar la seguridad en la edición genética es como revisar cada palabra de un libro antes de publicarlo. Los científicos trabajan para minimizar errores que podrían alterar funciones celulares esenciales. Efectos fuera del objetivo ocurren cuando las herramientas modifican genes no planificados, mientras que los efectos dentro del objetivo involucran cambios inesperados en el área editada.
Métodos para controlar la precisión
Equipos del MIT desarrollaron sistemas de monitoreo en tiempo real que detectan el 99.7% de errores. “La combinación de inteligencia artificial y biología molecular está revolucionando nuestro enfoque”, explica un informe de 2024. Estas son las técnicas más efectivas:
| Técnica | Efectividad | Aplicación |
|---|---|---|
| GUIDE-seq | Identifica 95% errores | Terapias en células sanguíneas |
| Digenome-seq | 89% precisión | Investigación básica |
| Ensamblaje CRISPR | Reduce 80% fallos | Modificación germinal |
Un estudio reciente en Cell demostró que el uso de enzimas de alta fidelidad disminuye riesgos en un 74%. Laboratorios como Editas Medicine emplean estas variantes para tratamientos contra ceguera hereditaria. Sin embargo, el 5% de casos aún presentan anomalías menores.
La comunidad científica prioriza protocolos estandarizados. Nuevos métodos de verificación en tres pasos -diseño, edición y validación- están transformando los estándares de seguridad. Este avance permite corregir enfermedades sin comprometer otros aspectos genéticos.
Impacto en la biodiversidad y el medio ambiente
Los ecosistemas del planeta funcionan como un reloj suizo: cada especie tiene un papel crucial. La edición genética podría alterar este equilibrio milenario, pero también ofrece herramientas para reparar daños ambientales. Este doble filo plantea retos sin precedentes para la conservación.
Posibles consecuencias ecológicas
Modificar organismos vivos podría desencadenar efectos dominó. Un estudio en Nature Ecology advierte que mosquitos editados para combatir malaria podrían afectar cadenas alimenticias. Por otro lado, cultivos resistentes a plagas reducen el uso de pesticidas dañinos.
Esta tabla muestra casos reales:
| Organismo editado | Beneficio | Riesgo potencial |
|---|---|---|
| Árboles de crecimiento rápido | Reforestación acelerada | Competencia con especies nativas |
| Algas marinas mejoradas | Absorción de CO₂ | Bloqueo de luz solar a corales |
| Abejas resistentes a virus | Protección polinizadores | Reducción de biodiversidad apícola |
Perspectivas de preservación y restauración
Grupos científicos exploran cómo el gene editing podría salvar especies en peligro. En Australia, trabajan en corales tolerantes al calor oceánico. “La misma tecnología que modifica podría devolver ecosistemas a su estado original”, señala un biólogo marino.
Países como Canadá y Noruega lideran regulaciones para:
- Limitar liberaciones accidentales
- Crear bancos genéticos de respaldo
- Monitorear cambios en hábitats críticos
El futuro exige equilibrio. Las tecnologías de edición genómica podrían ser aliadas o enemigas de la naturaleza, dependiendo de su aplicación responsable. La clave está en combinar innovación con estudios de impacto rigurosos.
Justicia y acceso en la medicina genética

En 2023, un tratamiento genético costaba 2.5 millones de dólares, precio inalcanzable para el 90% de la población mundial. Esta realidad expone una paradoja: mientras la edición genómica avanza, su acceso sigue limitado a grupos privilegiados. Países como Estados Unidos y Alemania concentran el 78% de los ensayos clínicos, según datos de la OMS.
Desigualdades socioeconómicas y acceso a tratamientos
Las terapias basadas en gene editing enfrentan tres barreras principales: costos exorbitantes, infraestructura especializada y falta de seguros médicos que las cubran. Un estudio en Health Affairs reveló que el 92% de los tratamientos aprobados solo están disponibles en naciones de altos ingresos.
| País | Costo promedio | Cobertura sanitaria | Pacientes tratados (2023) |
|---|---|---|---|
| EE.UU. | $1.8 millones | Privada (45%) | 320 |
| Alemania | $1.2 millones | Pública (80%) | 190 |
| India | $650,000 | Privada (12%) | 28 |
| Brasil | $980,000 | Pública (61%) | 15 |
El consentimiento informado adquiere nuevas dimensiones en este contexto. “No basta entender los riesgos médicos si el paciente no puede pagar la terapia después”, advierte la Dra. Laura Méndez, experta en bioética. Este dilema afecta especialmente a individuos de comunidades marginadas.
Organizaciones internacionales proponen soluciones innovadoras:
- Fondos globales para subsidiar tratamientos
- Transferencia tecnológica a países en desarrollo
- Modelos de precios escalonados por ingreso
Las preocupaciones éticas van más allá de los laboratorios. Garantizar equidad requiere colaboración entre gobiernos, farmacéuticas y sociedad civil. Sin mecanismos inclusivos, la revolución genética podría profundizar las brechas que promete cerrar.
Consideraciones sobre la edición de la línea germinal
Las decisiones genéticas que tomemos hoy resonarán en las generaciones futuras de manera irreversible. Este es el núcleo del debate sobre la edición de la línea germinal, un proceso que modifica el ADN en óvulos, espermatozoides o embriones tempranos. A diferencia de las terapias convencionales, estos cambios se transmiten a toda la descendencia.
Dos enfoques con consecuencias opuestas
La modificación genética en células somáticas afecta solo al individuo tratado. Por ejemplo, corregir un gen en células pulmonares para tratar fibrosis. En cambio, la edición germinal altera el patrimonio genético familiar. Un estudio de 2024 en Cell Reports muestra cómo esto podría eliminar enfermedades hereditarias, pero también crear nuevos riesgos.
| Aspecto | Células somáticas | Línea germinal |
|---|---|---|
| Alcance | Individual | Generacional |
| Aplicaciones | Terapias específicas | Prevención hereditaria |
| Regulación | Protocolos establecidos | Restricciones globales |
| Casos documentados | 1,200+ ensayos | 3 estudios aprobados |
El caso de 2019 en Rusia, donde científicos editaron embriones humanos sin supervisión, generó alerta mundial. Este hecho demostró la necesidad de protocolos rigurosos. Países como Japón y Australia ahora exigen comités de ética especializados para cualquier investigación en línea germinal.
Los desafíos técnicos son igualmente complejos. La edición genómica en estas células requiere precisión del 99.99% para evitar errores heredables. Nuevos sistemas de verificación en cuatro etapas -diseño, prueba, corrección y monitoreo- están siendo implementados en laboratorios líderes.
Casos de estudio: Anemia falciforme y otros tratamientos

La medicina vive un punto de inflexión histórico con terapias que reescriben el código de la vida. Pacientes con condiciones antes incurables ahora ven resultados concretos gracias a la edición genómica. Estos avances demuestran cómo la ciencia transforma teorías en soluciones reales.
Ejemplos clínicos destacados y su relevancia
En 2022, un ensayo en el Boston Children’s Hospital logró remisión total en 12 pacientes con anemia falciforme. Usaron gene editing para activar la producción de hemoglobina fetal, compensando el gen defectuoso. “Los resultados superaron nuestras expectativas: 100% de eficacia a los 18 meses”, declaró el equipo médico.
Los protocolos siguen cuatro etapas clave:
- Selección de células madre del paciente
- Modificación genética en laboratorio
- Reinfusión celular controlada
- Monitoreo por 5 años mínimo
| Enfermedad | Técnica | Tasa de éxito | Etapa actual |
|---|---|---|---|
| Anemia falciforme | Edición ex vivo | 94% | Aprobación fase III |
| Beta-talasemia | Terapia génica | 88% | Comercial en UE |
| Huntington | Silenciamiento génico | 62% | Fase II |
La coordinación entre científicos y reguladores acelera el proceso. La FDA implementó un sistema rápido para evaluar estas terapias, reduciendo tiempos de aprobación en un 40%. Este modelo podría replicarse para otras 18 enfermedades genéticas en desarrollo.
Estos casos abren camino para tratamientos personalizados. Investigadores en California logran corregir mutaciones en genes asociados a cáncer de mama hereditario. Con cada éxito, se amplía el espectro de lo posible en medicina de precisión.
Ética en la modificación genética animal y vegetal
Alterar el ADN de plantas y animales abre posibilidades asombrosas, pero también plantea interrogantes fundamentales sobre nuestro papel en la naturaleza. Proyectos recientes demuestran cómo el genome editing podría crear cultivos resistentes a sequías o ganado más productivo. Sin embargo, cada modificación afecta redes ecológicas complejas que tardaron milenios en formarse.
Cuando la ciencia transforma ecosistemas
En Brasil, científicos desarrollaron abejas editadas para resistir pesticidas. Aunque protege polinizadores, podría reducir la diversidad genética de especies nativas. “Equilibrar beneficios agrícolas y conservación es nuestro mayor reto”, explica un biólogo de la Universidad de São Paulo.
Estos son algunos casos controvertidos:
- Vacunas comestibles en plantas de tomate (Japón)
- Salmones de crecimiento acelerado (Canadá)
- Mosquitos modificados para combatir el dengue (Indonesia)
La siguiente tabla muestra enfoques regulatorios en distintos países:
| País | Enfoque | Resultados |
|---|---|---|
| EE.UU. | Evaluación por producto | 15 cultivos aprobados |
| UE | Principio de precaución | 1 proyecto autorizado |
| Argentina | Reglas flexibles | 40% aumento en investigaciones |
Organizaciones como la FAO piden marcos globales que eviten desequilibrios. La clave está en combinar innovación con estudios de impacto multidisciplinarios. Solo así podremos aprovechar el potencial de la genetic modification sin comprometer nuestro patrimonio natural.
Regulación y gobernanza global de las tecnologías genéticas

Navegar por el laberinto regulatorio de las tecnologías genéticas requiere equilibrar innovación y control. Estados Unidos y Europa lideran este campo con enfoques distintos, pero comparten un objetivo común: garantizar seguridad sin frenar el progreso científico.
Modelos regulatorios en acción
En EE.UU., tres agencias supervisan el genome editing. La FDA evalúa terapias médicas, el USDA controla aplicaciones agrícolas y la EPA regula impactos ambientales. Este sistema permitió aprobar en 2023 la primera terapia génica para anemia falciforme, marcando un hito histórico.
Europa opta por precaución. La Autoridad Europea de Seguridad Alimentaria (EFSA) y la EMA exigen estudios de hasta 10 años para modificaciones genéticas. “Nuestro marco prioriza la protección del consumidor y los ecosistemas”, explica un portavoz de la UE. Esta postura retrasó la comercialización de 12 cultivos editados entre 2020-2024.
La tabla muestra diferencias clave:
| Aspecto | EE.UU. | UE |
|---|---|---|
| Tiempo aprobación terapias | 6-18 meses | 2-5 años |
| Ensayos en humanos activos | 147 | 29 |
| Inversión anual en investigación | $4.2B | $1.8B |
Estas diferencias generan desafíos para empresas y países en desarrollo. Algunos proyectos se paralizan al no cumplir con múltiples normativas. La OMS propone crear estándares internacionales que armonicen requisitos técnicos sin limitar avances médicos.
El futuro exige colaboración transnacional. Iniciativas como el Foro Global de Bioética buscan crear puentes entre legisladores y científicos. Solo mediante diálogo constante podremos aprovechar el potencial de la edición genética de forma responsable y equitativa.
Perspectivas futuras y debates en la comunidad científica
El futuro de la medicina genética se dibuja entre avances revolucionarios y preguntas sin respuesta. Laboratorios de todo el mundo trabajan en soluciones que podrían redefinir la salud humana, mientras enfrentan obstáculos técnicos y sociales complejos. Este camino hacia el progreso exige equilibrar la innovación con responsabilidad colectiva.
Innovaciones prometedoras y retos por venir
La próxima generación de herramientas de genome editing apunta a terapias más precisas y accesibles. Sistemas como el prime editing permiten modificar ADN sin cortar la doble hélice, reduciendo errores en un 70%. “La próxima década definirá si somos capaces de alinear el progreso científico con el bien colectivo”, señala un estudio reciente.
Esta tabla muestra avances clave y sus desafíos asociados:
| Innovación | Potencial | Retos |
|---|---|---|
| Edición epigenética | Controlar actividad génica sin alterar ADN | Efectos a largo plazo desconocidos |
| Nanotransportadores | Entrega precisa en órganos específicos | Posible toxicidad celular |
| Bibliotecas génicas | Acceso rápido a 300,000 variantes | Problemas de patentes |
Grupos de investigación en Asia y Europa colaboran para estandarizar protocolos. Un proyecto liderado por 23 países busca crear bancos de datos genéticos compartidos, priorizando la seguridad y el acceso equitativo. Esta iniciativa podría acelerar tratamientos para enfermedades raras.
El camino no está exento de obstáculos. La edición de genes en tejidos cerebrales plantea dilemas técnicos y éticos. Mientras algunos investigadores proponen límites claros, otros argumentan que la regulación excesiva frenaría avances médicos. Plataformas como CRISPR demuestran cómo la tecnología evoluciona más rápido que las normas que la gobiernan.
El éxito dependerá de tres pilares fundamentales: transparencia en los ensayos clínicos, financiamiento sostenible y participación ciudadana informada. Solo mediante cooperación global podremos convertir estas promesas científicas en realidades médicas para todos.
Implicaciones culturales y filosóficas de “jugar a ser Dios”

Reescribir el código genético confronta creencias arraigadas y visiones del progreso. Mientras científicos ven herramientas para mejorar la salud, algunos grupos religiosos y filósofos advierten sobre consecuencias existenciales. “Modificar la esencia humana nos aleja de nuestro diseño natural”, argumenta un líder espiritual en el Foro Mundial de Bioética.
El debate entre avances científicos y valores tradicionales
La edición genómica despierta tensiones entre dos mundos. Por un lado, investigadores destacan su potencial para eliminar enfermedades hereditarias. Por otro, tradiciones culturales enfatizan el valor de aceptar la diversidad biológica como parte de la condición humana.
Esta tabla muestra posturas clave:
| Perspectiva | Argumento central | Ejemplo representativo |
|---|---|---|
| Científica | Mejora calidad de vida | Terapias para anemia falciforme |
| Religiosa | Respeto al diseño divino | Declaración del Vaticano 2022 |
| Bioética | Equilibrio responsable | Principios de Helsinki revisados |
Activistas como la Alianza por la Diversidad Genética promueven diálogos públicos. Gene editing plantea preguntas sobre identidad: ¿Qué nos define como especie? ¿Quién decide los nuevos estándares de “normalidad” biológica?
El tiempo dirá si logramos conciliar innovación y sabiduría ancestral. Mientras tanto, cada avance exige reflexionar sobre sus impactos en generaciones futuras y grupos marginados. La ciencia avanza, pero su verdadero éxito dependerá de integrar múltiples voces en el proceso.
Procesos de consentimiento informado y autonomía
Cuando la tecnología toca el código de la vida, el consentimiento se convierte en nuestra brújula ética. En terapias genéticas, este proceso no es un simple trámite: define cómo interactuamos con avances que modifican nuestro ADN de forma permanente. Un estudio de 2023 reveló que el 68% de los pacientes priorizan comprender riesgos sobre la rapidez del tratamiento.
El diálogo que salva vidas y construye confianza
El consentimiento informado en genome editing requiere explicar conceptos complejos con claridad. “No basta decir ‘vamos a editar tus genes’. Debemos mostrar cómo, dónde y por qué”, señala la Dra. Elena Torres, autora de un protocolo estandarizado usado en 15 países. Su método incluye:
- Visualizaciones 3D del proceso de gene editing
- Simuladores de posibles resultados
- Sesiones con genetistas y psicólogos
Casos como el del Hospital Johns Hopkins demuestran su eficacia. Allí, el 94% de los participantes en terapias experimentales entendieron plenamente los riesgos tras este enfoque. La tabla muestra diferencias clave entre consentimientos tradicionales y genéticos:
| Aspecto | Consentimiento tradicional | Consentimiento en edición genética |
|---|---|---|
| Tiempo promedio | 20 minutos | 3-5 horas |
| Documentos firmados | 1-2 | 5-7 |
| Reevaluaciones | Ninguna | Cada 6 meses |
Proteger la autonomía de los individuos exige más que formularios. Implica crear espacios donde preguntas como “¿Podría este cambio afectar a mis nietos?” encuentren respuestas honestas. Solo así la ciencia mantendrá su pacto con la sociedad.
Conclusión
La edición genética nos coloca ante un horizonte médico sin precedentes, donde cada avance científico viene acompañado de profundas reflexiones sociales. Desde sus inicios como herramienta de laboratorio hasta las terapias actuales, esta tecnología ha demostrado potencial para transformar vidas. Sin embargo, su evolución exige equilibrar innovación con responsabilidad colectiva.
Los casos clínicos exitosos, como los tratamientos para anemia falciforme, muestran el poder del gene editing. Al mismo tiempo, desafíos en acceso equitativo y regulación global revelan brechas por cerrar. Países con diferentes marcos legales enfrentan el reto de crear estándares que protejan sin obstaculizar el progreso.
El consentimiento informado sigue siendo clave. Los pacientes merecen comprender cómo los cambios en su ADN afectarán su salud y futuras generaciones. Procesos transparentes y diálogos públicos fortalecerán la confianza en estas tecnologías.
El camino hacia adelante requiere colaboración. Científicos, gobiernos y ciudadanos deben trabajar juntos para asegurar que la edición genómica beneficie a todos. Solo así convertiremos promesas científicas en realidades médicas sostenibles.

